



物理化学分野による研究成果が「Protein Science」誌に掲載されました
2022.08.09
本学薬学科の物理化学分野(的場 康幸 准教授)と広島大学の共同研究成果「Catalytic mechanism of DcsB: Arginase framework used for hydrolyzing its inhibitor」が「Protein Science」誌に掲載されました。(https://doi.org/10.1002/pro.4338)
一酸化窒素合成の中間体として知られている「N-ヒドロキシ-L-アルギニン」は、尿素を合成する酵素アルギナーゼに対する阻害剤として働くことが知られています。一方、抗結核薬D-サイクロセリンの生合成経路から見出された放線菌が産生する酵素DcsBは、アルギナーゼとアミノ酸配列上の類似性を有しているのにも関わらず、N-ヒドロキシ-L-アルギニンを特異的に加水分解します。この基質特異性がなぜ生まれるかはこれまで不明でした。今回、別のアルギナーゼ阻害剤と結合したDcsBのX線結晶構造解析を行うことにより、DcsBの基質結合ポケットはアルギナーゼのものに比べて狭くなっていることが明らかになり、そのことが本酵素の基質特異性を生んでいることが明らかになりました。また、DcsBの活性中心近傍に陽イオン結合部位が見出されたことから、反応途中で生じたヒドロニウムイオン(H3O+)がその部位に結合し、H+を与えて化学反応を触媒する特殊酸触媒として働く可能性が見いだされました。以上のことは、特殊な反応を触媒する人工酵素を設計する際に役立ち、医薬品を含む化合物の合成分野に応用されることが期待できます。
参考:
1. Kosuke Oda, Takemasa Sakaguchi, Yasuyuki Matoba, Protein Science, 31, e4338, 2022
2. Kosuke Oda, Natsuki Shimotani, Teruo Kuroda, Yasuyuki Matoba, Acta Crystallographica Section D Structural Biology, 76, 506-514, 2020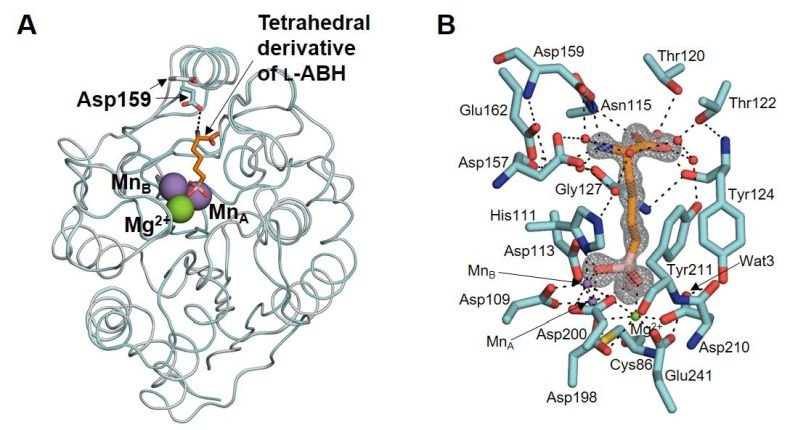
X線構造解析で明らかになったアルギナーゼ阻害剤との結合によるDcsBの構造変化(白色が非結合型、水色が結合型)(A)と阻害剤と結合したDcsBの活性中心の構造(B)